मुंह की श्लेष्मा झिल्ली के माध्यम से मौखिक रूप से दी जाने वाली TH104 की फार्माकोकाइनेटिक विशेषताएं अंतःशिरा रूप से दी गई संदर्भ दवा के समान हैं, TH104 ने केवल हल्के दुष्प्रभावों के साथ एक अनुकूल सुरक्षा प्रोफ़ाइल का प्रदर्शन किया
थारिम्यून, इंक. (नैस्डैक: टीएचएआर) ने TH104 के अपने प्रारंभिक नैदानिक अध्ययन से उत्साहजनक परिणामों की घोषणा की है, जो मुंह के अंदर श्लेष्म झिल्ली के माध्यम से प्रशासन के लिए डिज़ाइन की गई दवा है, जो एक फिल्म का उपयोग करके मुंह के अंदर श्लेष्म झिल्ली के माध्यम से प्रशासन के लिए डिज़ाइन की गई दवा है जो जल्दी से घुल जाती है। स्वस्थ प्रतिभागियों पर किए गए अध्ययन से पता चला है कि जब TH104 को मुंह के माध्यम से या अंतःशिरा रूप से दिया जाता था, तब फार्माकोकाइनेटिक पैटर्न सुसंगत थे, और सुरक्षा और सहनशीलता दोनों तरीकों के
लिए समान थी। थारिम्यूनके मुख्य कार्यकारी अधिकारी रैंडी मिल्बी ने कहा, “TH104 के चरण 1 के अध्ययन ने पूर्वानुमेय फार्माकोकेनेटिक्स के लिए हमारी अपेक्षाओं को पूरा किया है और श्लेष्म झिल्ली के माध्यम से प्रशासित होने पर यह सुरक्षित और अच्छी तरह से सहन किया गया है।” “हम इस अध्ययन में भाग लेने वाले स्वयंसेवकों के आभारी हैं, जो इस आशाजनक उपचार के विकास के साथ आगे बढ़ने के लिए एक महत्वपूर्ण कदम है।”
TH104 थारिम्यून का प्राथमिक नैदानिक उत्पाद है और इसे यकृत द्वारा प्रारंभिक प्रसंस्करण को बायपास करने के लिए डिज़ाइन किया गया है जो आमतौर पर मौखिक दवाओं से गुजरता है। यह यकृत से संबंधित और खुजली का कारण बनने वाली अन्य सूजन संबंधी स्थितियों के लिए इसे बेहतर उपचार विकल्प बना सकता है। दवा दो विशिष्ट ओपिओइड रिसेप्टर्स, म्यू और कप्पा को लक्षित करके काम करती है, जिन्हें खुजली के प्रति शरीर की प्रतिक्रिया में भूमिका निभाने के लिए जाना जाता है, विशेष रूप से यकृत की स्थितियों में जिसके कारण पित्त जमा होता है
।चरण 1 का अध्ययन एक सिंगल-डोज़, सिंगल-सेंटर, नॉन-ब्लाइंड, रैंडमाइज्ड क्रॉसओवर ट्रायल था, जिसमें 16 मिलीग्राम TH104 की तुलना 1mg इंट्रावेनस नालमेफ़ेन के साथ की गई थी। परीक्षण में खुराक के बीच 7-दिन की प्रतीक्षा अवधि शामिल थी। बीस स्वस्थ स्वयंसेवकों को भर्ती किया गया, और सभी ने अध्ययन पूरा किया। मुख्य लक्ष्य TH104 की पूर्ण जैव उपलब्धता, साथ ही इसकी सुरक्षा और सहनशीलता का निर्धारण करना था
।अध्ययन में पाया गया कि TH104 की जैव उपलब्धता, जो कि अंतःशिरा रूप की तुलना में रक्तप्रवाह में प्रवेश करने वाली दवा का अनुपात है, लगभग 46% थी। TH104 के लिए रक्त में अधिकतम सांद्रता तक पहुंचने का औसत समय 2 घंटे था, और रक्त में रहने की औसत अवधि मुंह के माध्यम से एक खुराक के बाद 14 घंटे थी, जबकि अंतःशिरा खुराक के लिए यह 9 घंटे
थी।ये परिणाम मौखिक और अंतःशिरा नालमेफेन के फार्माकोकेनेटिक्स पर पहले प्रकाशित आंकड़ों के साथ संरेखित होते हैं, जो दर्शाता है कि प्राथमिक पित्तवाहिनीशोथ के कारण लगातार, गंभीर खुजली वाले रोगियों में TH104 एक बार दैनिक खुराक के लिए उपयुक्त हो सकता है।
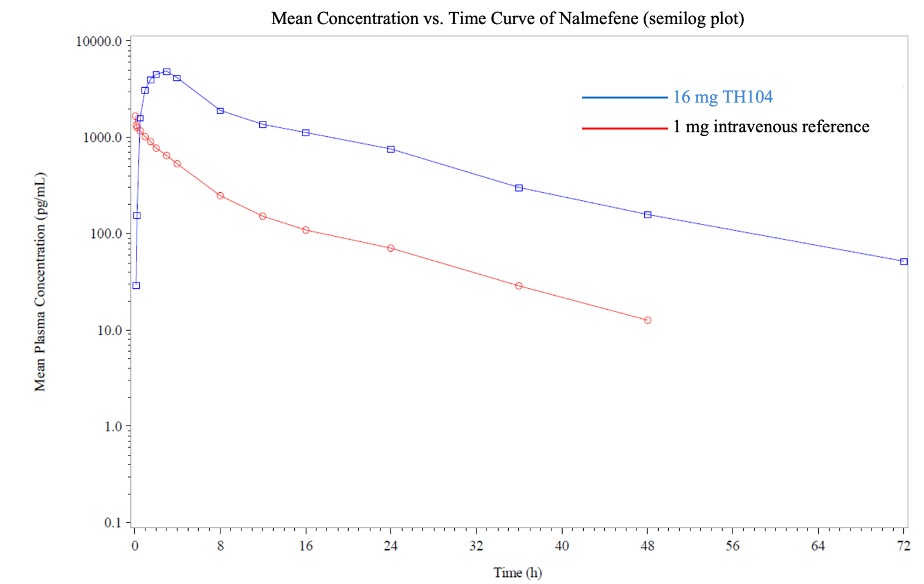
चरण 1 के अध्ययन से यह भी पता चला है कि TH104 की 16mg खुराक में सुरक्षा और सहनशीलता प्रोफ़ाइल थी, जो FDA-अनुमोदित अंतःशिरा रूप के नलमेफ़ेन की 1mg खुराक की तुलना में थी। TH104 समूह में 40% प्रतिभागियों और अंतःशिरा समूह में 37% प्रतिभागियों द्वारा उपचार से संबंधित दुष्प्रभावों की सूचना दी गई, जिसमें सभी दुष्प्रभाव हल्के थे। चक्कर आना दोनों समूहों के लिए सबसे आम दुष्प्रभाव था
।कोई गंभीर दुष्प्रभाव नहीं बताया गया, और किसी भी प्रतिभागी ने साइड इफेक्ट्स के कारण अध्ययन नहीं छोड़ा। TH104 फिल्म लेने से पहले या बाद में मुंह की श्लेष्मा झिल्ली की दृश्य परीक्षाओं में कोई असामान्य निष्कर्ष नहीं मिले
।थारिम्यून एफडीए के साथ चरण 2 के परीक्षण पर चर्चा करना जारी रखता है और 2024 में प्राथमिक पित्तवाहिनीशोथ के कारण लगातार, गंभीर खुजली वाले रोगियों में TH104 के लिए नैदानिक परीक्षण शुरू करने की योजना बना रहा है।
TH104 TH104 के बारे में
एक दवा है जिसे मुंह के अंदर श्लेष्म झिल्ली के माध्यम से प्रशासन के लिए एक फिल्म पर रखा जाता है। इसे यकृत से संबंधित कई और अन्य सूजन संबंधी स्थितियों के इलाज के लिए डिज़ाइन किया गया है जो खुजली का कारण बनती हैं। दवा म्यू और कप्पा ओपिओइड रिसेप्टर्स को लक्षित करती है, जो खुजली के प्रति शरीर की प्रतिक्रिया में शामिल होते हैं
।थारिम्यून के बारे में
थारिम्यून, इंक. एक कंपनी है जो सूजन और प्रतिरक्षा प्रणाली से संबंधित स्थितियों के लिए उपचार विकसित करने पर केंद्रित है। इसके प्रमुख क्लिनिकल-स्टेज उत्पाद, TH104, का उद्देश्य प्राथमिक पित्तवाहिनीशोथ में पुरानी, गंभीर खुजली को कम करना है, जो एक दुर्लभ यकृत रोग है जिसका कोई ज्ञात इलाज नहीं है। थारिम्यून विभिन्न ठोस ट्यूमर के लिए नए एंटीबॉडी भी विकसित कर रहा है। एंटीबॉडी डिस्कवरी तकनीक तक पहुंच के लिए कंपनी ने OmniAb, Inc. के साथ एक समझौता किया है।
अधिक जानकारी के लिए, www.tharimmune.com पर जाएं।फॉरवर्ड-लुकिंग स्टेटमेंट इस प्रेस विज्ञप्ति में दिए गए
कुछ बयान दूरंदेशी हैं और 1995 के निजी प्रतिभूति मुकदमेबाजी सुधार अधिनियम के अनुसार बनाए गए हैं। ये कथन ऐतिहासिक तथ्यों से संबंधित नहीं हैं, बल्कि भविष्य के संचालन, वित्तीय स्थिति, लागत, संभावनाओं, योजनाओं और थारिइम्यून के प्रबंधन के उद्देश्यों से संबंधित हैं। “पूर्वानुमान,” “विश्वास,” “अनुमान,” “उम्मीद,” “इरादा,” “हो सकता है,” “योजना,” “भविष्यवाणी,” “परियोजना,” “लक्ष्य,” “चाहिए,” “होगा,” जैसे शब्द और इसी तरह के भाव इन दूरंदेशी कथनों की पहचान करते हैं। वास्तविक परिणाम या घटनाएं इन कथनों में उल्लिखित परिणामों से काफी भिन्न हो सकती हैं। 31 दिसंबर, 2023 को समाप्त होने वाले वर्ष के लिए हमारी वार्षिक रिपोर्ट के जोखिम कारक अनुभाग और प्रतिभूति और विनिमय आयोग के पास दायर अन्य आवधिक रिपोर्टों में इस तरह के अंतर का कारण बनने वाले कारकों का विवरण दिया गया है। इसके अलावा, इस प्रेस विज्ञप्ति में व्यक्त किए गए विचार इसकी तारीख के अनुसार हैं और बाद में बदल सकते हैं। थारिम्यून इन फॉरवर्ड-लुकिंग स्टेटमेंट्स को कानून द्वारा आवश्यक के अलावा अपडेट करने के लिए प्रतिबद्ध नहीं
संदर्भ
काइल, एलबी, शेन, एल।, फेरच, केयू, सोएगार्ड, बी।, लार्सन, एफ।, और अरेबर्ग, जे (2016)। म्यू-ओपिओइड रिसेप्टर बाइंडिंग के संबंध में स्वस्थ व्यक्तियों में नालमेफेन के फार्माकोकेनेटिक्स ब्रिटिश जर्नल ऑफ़ क्लिनिकल फ़ार्माकोलॉजी, 81 (2), 290-300
।संपर्क:
थारिम्यून, इंक. LHA निवेशक संबंध
ir@tharimmune.com
तीर्थ टी. पटेल
tpatel@lhai.com
212-201-6614
accesswire.com पर मूल प्रेस विज्ञप्ति देखें
यह लेख AI के समर्थन से तैयार और अनुवादित किया गया था और एक संपादक द्वारा इसकी समीक्षा की गई थी। अधिक जानकारी के लिए हमारे नियम और शर्तें देखें
।